Cellules souches, développement et évolution
Eve GAZAVE
 Notre équipe étudie l’évolution des cellules souches et la régénération chez les animaux. Le principal modèle biologique étudié par l’équipe est le ver annélide Platynereis dumerilii, une espèce modèle émergente pour les études du développement et de l’évolution. Nous caractérisons, à l’aide d’une grande variété d’outils moléculaires, cellulaires et génomiques, les étonnantes capacités de régénération de cet animal, dans le but général de déterminer, par des analyses comparatives, si la régénération chez les animaux repose ou non sur des mécanismes et des programmes génétiques conservés. En utilisant une combinaison d’approches expérimentales et in silico, nous cherchons également à comprendre comment les cellules souches impliquées dans le développement, la croissance et la régénération ont évolué chez les animaux.
Notre équipe étudie l’évolution des cellules souches et la régénération chez les animaux. Le principal modèle biologique étudié par l’équipe est le ver annélide Platynereis dumerilii, une espèce modèle émergente pour les études du développement et de l’évolution. Nous caractérisons, à l’aide d’une grande variété d’outils moléculaires, cellulaires et génomiques, les étonnantes capacités de régénération de cet animal, dans le but général de déterminer, par des analyses comparatives, si la régénération chez les animaux repose ou non sur des mécanismes et des programmes génétiques conservés. En utilisant une combinaison d’approches expérimentales et in silico, nous cherchons également à comprendre comment les cellules souches impliquées dans le développement, la croissance et la régénération ont évolué chez les animaux.
Mots-clés : Régénération, cellules souches, évolution, annélides, épigénétique, génomique comparative, développement, cellules germinales, pluripotence, reprogrammation cellulaire, croissance.
+33 (0)1 57 27 81 01 Contact @stemdevevo.bsky.social https://stemdevevo.wordpress.com/
Les cellules souches, qui ont à la fois la capacité d’auto-renouvellement et de production de cellules différenciées, sont des acteurs clés du développement embryonnaire chez les animaux. Ces cellules sont également impliquées dans des processus post-embryonnaires comme la croissance, dans l’homéostasie des tissus, ainsi que, chez certains animaux, dans la reproduction asexuée et la régénération. La régénération, la capacité de restaurer des parties perdues ou amputées du corps, est un phénomène très répandu chez les animaux. Bien que cette capacité soit très limitée chez les mammifères, de nombreux animaux (tels les éponges, les cnidaires, les planaires, les annélides et les salamandres) sont capables de régénérer des structures complexes, leurs membres par exemple, et dans certains cas la totalité de leur corps à partir d’un petit morceau de tissu. La régénération est souvent basée sur la présence de populations de cellules souches, soit pluripotentes et donc capables de régénérer tous les tissus du corps, soit multipotentes et donc avec des potentialités plus restreintes. La régénération peut aussi dépendre de phénomènes de dédifférenciations cellulaires locales par lesquels des cellules différenciées sont reprogrammées en progéniteurs ou cellules souches prolifératives.
Notre équipe cherche à comprendre l’évolution des cellules souches et de la régénération chez les animaux. Notre principal modèle d’étude pour aborder ces thématiques est l’annélide marine Platynereis dumerilii (Figure 1).
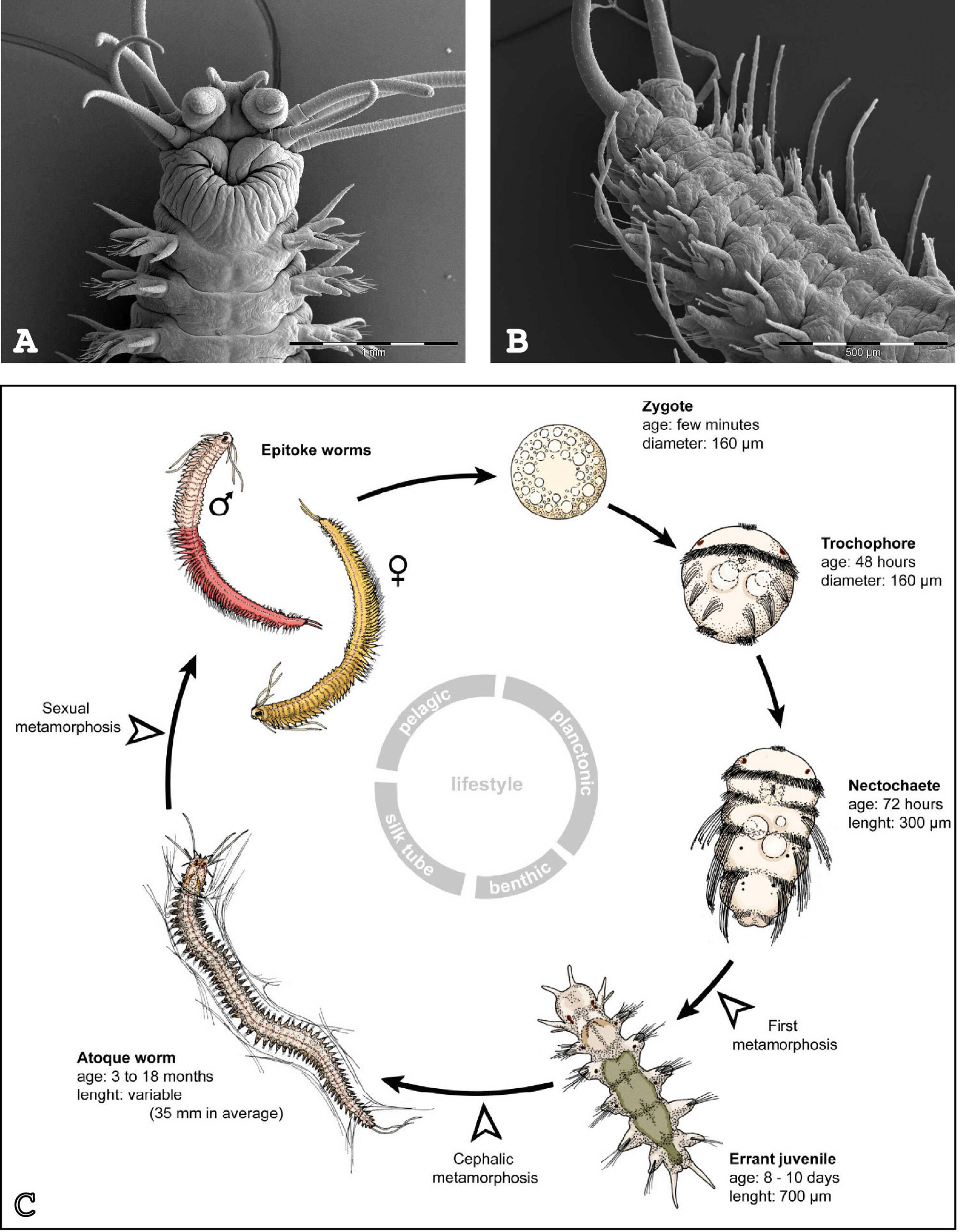
Figure 1 : Platynereis dumerilii et son cycle de vie. (A) Vue dorsale de la tête de l’adulte. (B) Vue ventrale de la partie postérieure de l’adulte. (C) Cycle de vie. Les photographies en (A) et (B) ont été faites par le Dr. Nicolas Dray (CNRS). Le schéma en C est adapté de Demilly et al. 2013.
Les annélides appartiennent aux lophotrochozoaires, la troisième grande lignée évolutive des bilatériens, aux côtés des deutérostomes (vertébrés, échinodermes, …) et des ecdysozoaires (arthropodes, nématodes, …). Platynereis s’est révélé extrêmement précieux pour les comparaisons évolutives à grande échelle et se prête à des analyses moléculaires et fonctionnelles. Après le développement embryonnaire et larvaire, les vers Platynereis grandissent pendant la majeure partie de leur vie, en ajoutant séquentiellement de nouveaux segments dans la partie postérieure de leur corps, un processus connu sous le nom d’élongation ou croissance postérieure. Nous avons montré que cette propriété est liée à la présence de cellules souches putatives situées dans une zone de croissance subterminale (Gazave et al., 2013). Les cellules souches de la zone de croissance présentent une signature moléculaire (faite de l’expression d’une vingtaine de gènes) similaire à celle des cellules souches pluripotentes présentes chez d’autres animaux et à celle des cellules germinales primordiales.
Pendant leur phase de croissance, les vers Platynereis présentent également des capacités de régénération étendues. Après amputation, Platynereis régénère la partie postérieure de son corps qui comprend à la fois les structures différenciées de la partie la plus postérieure de leur corps et les cellules souches de la zone de croissance dont la prolifération permet le remplacement des segments amputés. Nous avons réalisé une caractérisation approfondie de ce processus de régénération, que nous avons appelé régénération postérieure (Figure 2) (Planques et al., 2019). Nous avons montré que la régénération est un processus rapide qui suit une chronologie bien reproductible, passant par des stades spécifiques bien caractérisés. La cicatrisation de la plaie est réalisée en 1 jour et un blastème de régénération se forme 1 jour plus tard. À ce stade, une certaine spécification tissulaire se produit déjà, et une zone de croissance postérieure fonctionnelle est rétablie dès le troisième jour après l’amputation. Nous avons également montré qu’une prolifération cellulaire intense se produit et est strictement nécessaire pour que la régénération se déroule normalement.
En plus de la région postérieure de son corps, les vers Platynereis peuvent également régénérer avec succès divers types d’excroissances corporelles, en particulier leurs appendices appelés parapodes. En revanche, Platynereis n’est pas capable de régénérer sa tête après une amputation. Alors que les vers peuvent survivre pendant plusieurs jours après l’amputation de la tête et qu’un blastème de régénération se forme, ce blastème antérieur ne produit jamais de structures différenciées de la tête (régénération avortée).
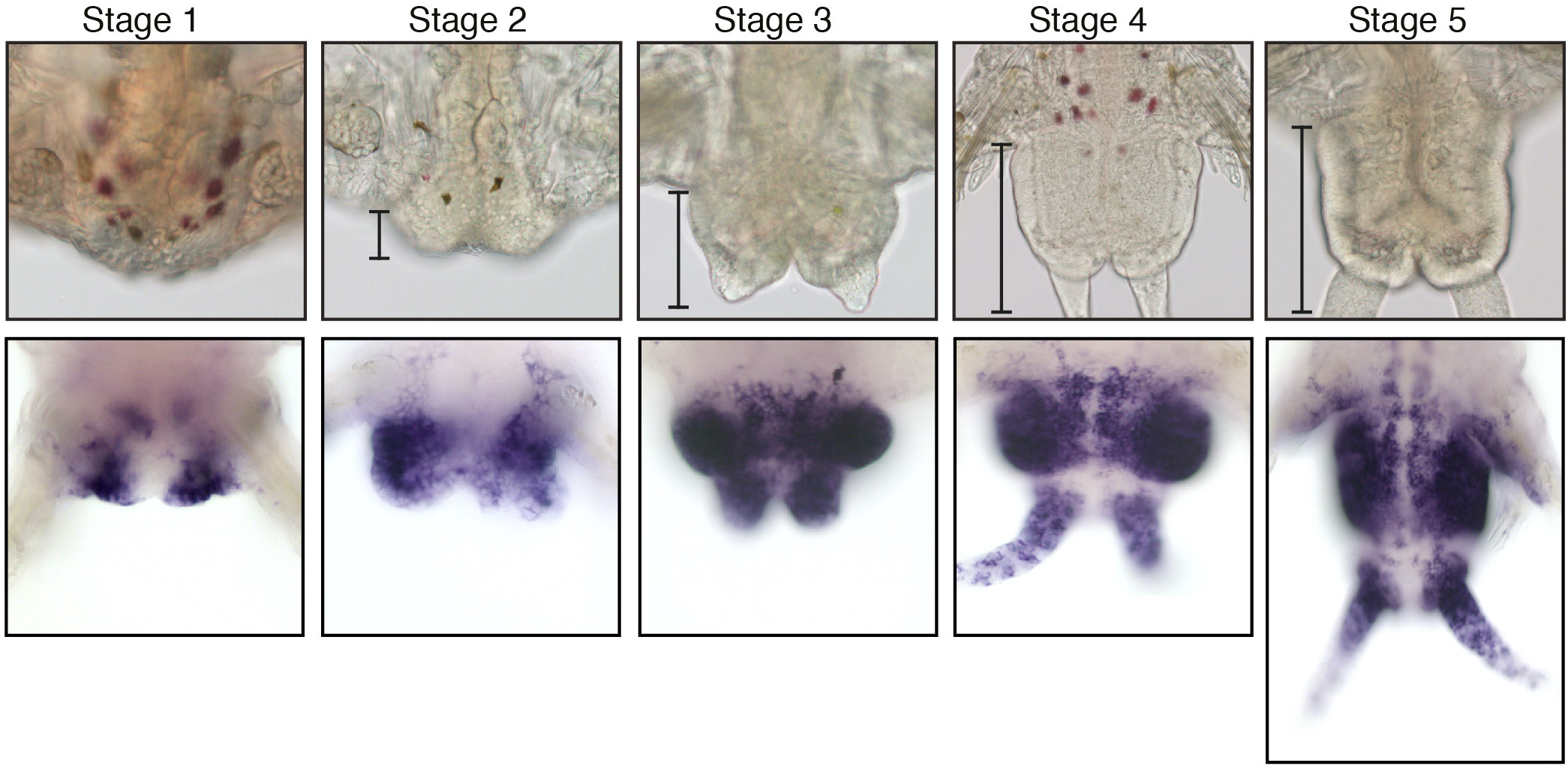
Figure 2 : Régénération postérieure chez Platynereis dumerilii. (Panneau supérieur) Images de microscopie à champ clair des 5 stades bien définis de la régénération postérieure. Les parenthèses mettent en évidence la région régénérée dont la taille augmente progressivement au cours des différentes étapes. (Panneau inférieur) Expression aux différents stades de la régénération du gène PCNA de Platynereis, un marqueur de la prolifération cellulaire, qui est exprimé tout au long de la régénération. Les images sont issues de Planques et al, 2019.
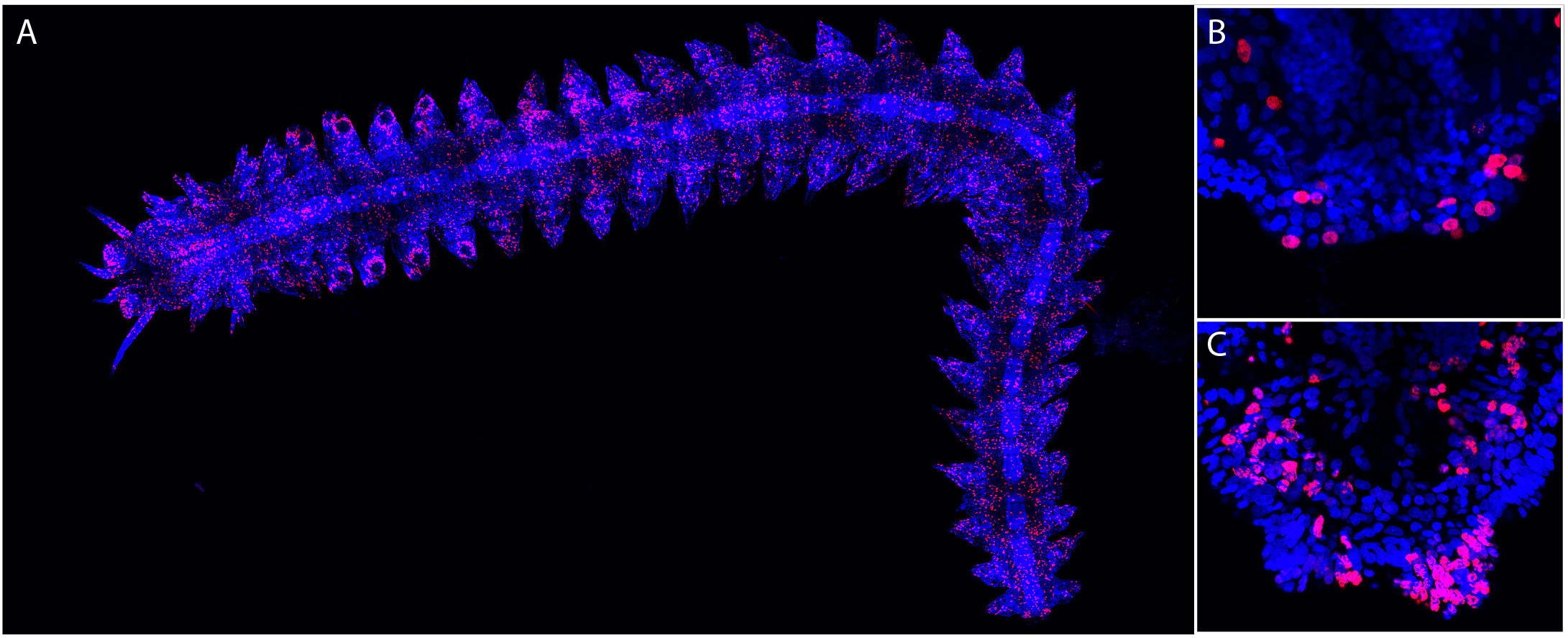
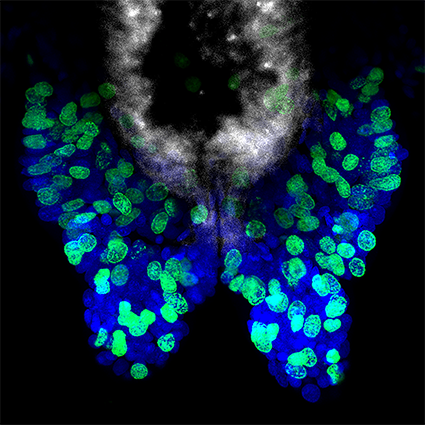
Figure 3 : Le marquage EdU met en évidence les cellules en prolifération chez Platynereis. Le marquage EdU (rouge) et la coloration nucléaire Hoechst (bleu) sont montrés. (A) Marquage EdU du ver entier avec incorporation d’EdU, pendant 5 heures, 1 jour après l’amputation (la partie antérieure du ver est à gauche). De nombreuses cellules EdU+ sont trouvées dans tout le corps. (B) Vue à plus fort grossissement de la partie postérieure du ver présenté en (A), mettant en évidence la présence de cellules EdU+ dans la région régénérée. (C) Partie postérieure d’un ver après un séjour de 48h dans de l’eau de mer normale. De nombreuses cellules EdU+ sont trouvées dans la région régénérée. Les images sont issues de Planques et al. 2019.
En utilisant une variété d’approches, nous cherchons à mieux comprendre les étonnantes capacités de régénération de Platynereis et à identifier les mécanismes conservés et les programmes génétiques qui sous-tendent la régénération chez les animaux. Nous étudions également l’évolution des cellules souches chez les animaux. Plus spécifiquement, nos projets de recherche s’organisent autour de cinq axes majeurs :
(i) Origine(s) et destin(s) des cellules du blastème de régénération chez Platynereis. Nous avons obtenu des preuves que les cellules du blastème dérivent principalement de la dédifférenciation des cellules des tissus adjacents au plan d’amputation, qui commencent, peu après l’amputation, à exprimer des marqueurs de prolifération et de cellules souches pluripotentes, ce qui suggère que l’amputation induit une reprogrammation cellulaire importante vers une identité de progéniteur/cellule souche (Planques et al., 2010 ; Bideau et al., en préparation). Nous développons actuellement des approches de lignage cellulaire et de transcriptomique en cellule unique (single-cell RNA-seq) pour caractériser davantage le processus de dédifférenciation et évaluer l’identité et le destin des cellules du blastème.
(ii) Voies impliquées dans l’initiation et le contrôle de la régénération postérieure chez Platynereis. Nous testons l’hypothèse selon laquelle l’apoptose et la production d’espèces réactives de l’oxygène (ROS) peuvent être importantes pour déclencher la régénération, notamment en stimulant la prolifération cellulaire nécessaire à la régénération, sur la base des connaissances obtenues chez d’autres animaux ayant des capacités de régénération (revue récente dans Vullien et al., 2021). Nous étudions également le(s) rôle(s) potentiel(s) des voies de signalisation pendant la régénération et avons déjà identifié deux voies (Notch et Wnt/beta-caténine) qui sont nécessaires à une régénération correcte.
(iii) Comparaison des différents processus de régénération chez Platynereis. Nous souhaitons comparer les régénérations réussies (partie postérieure du corps et parapodes) et avortées (tête) afin d’identifier les mécanismes nécessaires à une régénération réussie. Dans ce but, nous avons commencé à caractériser la régénération des parapodes et de la tête au niveau moléculaire, cellulaire et transcriptomique, afin de comparer les données obtenues pour ces deux événements de régénération avec celles déjà obtenues pour la régénération postérieure.
(iv) Régulations épigénétiques pendant la régénération de Platynereis. Nous avons obtenu des données transcriptomiques qui indiquent qu’un grand nombre de gènes sont exprimés de manière différentielle pendant la régénération. Nous avons testé l’hypothèse selon laquelle les régulations épigénétiques peuvent être impliquées dans ces changements dramatiques de l’expression des gènes qui se produisent après l’amputation. Nous avons obtenu des preuves de l’implication de la méthylation de l’ADN et de certaines modifications des histones pendant la régénération (Planques et al., 2021 ; Schenkelaars et al., en préparation). Nous utilisons des approches épigénomiques (par exemple, ATAC-seq et Cut&Tag) pour caractériser davantage cette implication et identifier le réseau de régulation génique qui soutient la régénération chez Platynereis.
(v) Évolution des cellules souches chez les animaux. Nous avons précédemment montré que la croissance des vers Platynereis repose sur la présence de cellules souches postérieures qui expriment des marqueurs de cellules souches somatiques pluripotentes et cellules souches germinales (Gazave et al., 2013). Nous cherchons à définir si des cellules souches ayant une signature moléculaire similaire pourraient être présentes chez d’autres animaux qui allongent progressivement leur corps, comme le fait Platynereis. Dans ce but, nous avons commencé à étudier la croissance du corps chez un chordé, l’amphioxus Branchiostoma lanceolatum, et prévoyons également de caractériser la croissance chez les crustacés. Nous caractérisons également l’évolution des cellules souches chez les animaux en définissant et en comparant les signatures moléculaires d’une grande variété de cellules souches provenant de différents animaux à l’aide de données transcriptomiques publiées.
Membres
 Loeiza BADUEL, Technicienne en biologie, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 293B
Loeiza BADUEL, Technicienne en biologie, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 293B Yves CLEMENT, Enseignant-chercheur, GAZAVE LAB+33 (0)1 57 27 80 03, bureau 283B
Yves CLEMENT, Enseignant-chercheur, GAZAVE LAB+33 (0)1 57 27 80 03, bureau 283B Pierre KERNER, Enseignant-chercheur, GAZAVE LAB+33 (0)1 57 27 20 24, bureau 283B
Pierre KERNER, Enseignant-chercheur, GAZAVE LAB+33 (0)1 57 27 20 24, bureau 283B Gabriel KRASOVEC, Postdoctorant, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 290B
Gabriel KRASOVEC, Postdoctorant, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 290B Brice PICHARD, Doctorant, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 293B
Brice PICHARD, Doctorant, GAZAVE LAB+33 (0)1 57 27 81 01, bureau 293B Rémi STREHL, Stagiaire, GAZAVE LABbureau 293B
Rémi STREHL, Stagiaire, GAZAVE LABbureau 293B Zoé VELASQUILLO RAMIREZ, Doctorante, GAZAVE LAB+33 (0)1 57 27 80 03, bureau 293B
Zoé VELASQUILLO RAMIREZ, Doctorante, GAZAVE LAB+33 (0)1 57 27 80 03, bureau 293B Ngoc Minh VU, Stagiaire, GAZAVE LAB
Ngoc Minh VU, Stagiaire, GAZAVE LAB
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
- Vullien, A., Amiel, A. R., Baduel, L., Diken, D., Renaud, C., Krasovec, G., Vervoort, M., Röttinger, E., & Gazave, E. (2025). The Rich Evolutionary History of the Reactive Oxygen Species Metabolic Arsenal Shapes Its Mechanistic Plasticity at the Onset of Metazoan Regeneration. Molecular Biology and Evolution, 42(1), msae254. https://doi.org/10.1093/molbev/msae254
Bideau, L., Velasquillo-Ramirez, Z., Baduel, L., Basso, M., Gilardi-Hebenstreit, P., Ribes, V., Vervoort, M., & Gazave, E. (2024). Variations in cell plasticity and proliferation underlie distinct modes of regeneration along the antero-posterior axis in the annelid Platynereis. Development, 151(20), dev202452. https://doi.org/10.1242/dev.202452
- Bideau L, Kerner P, Hui J, Vervoort M, Gazave E. Animal regeneration in the era of transcriptomics. Cell Mol Life Sci. 2021 78(8):3941-3956. https://doi.org/10.1007/s00018-021-03760-7.
- Planques, A., Kerner, P., Ferry, L., Grunau, C., Gazave, E., & Vervoort, M. (2021). DNA methylation during development and regeneration of the annelid Platynereis dumerilii. BMC Biology, 19(1), 148. https://doi.org/10.1186/s12915-021-01074-5.
- Planques, A., Malem, J., Parapar, J., Vervoort, M., Gazave, E. (2019) Morphological, cellular and molecular characterization of posterior regeneration in the marine annelid Platynereis dumerilii. Dev Biol. 445(2):189-210. https://doi.org/10.1101/352211
- Özpolat, B.D., Handberg-Thorsager, M., Vervoort, M. & Balavoine, G. (2017) Cell lineage and cell cycling analyses of the 4d micromere using live imaging in the marine annelid Platynereis dumerilii. eLife, 6, e30463. http://dx.doi.org/10.7554/eLife.30463
- Gazave E., Lemaître Q., and Balavoine G. (2017) The Notch pathway in the annelid Platynereis: Insights into chaetogenesis and neurogenesis processes. Open Biology 7(2). http://dx.doi.org/10.1098/rsob.160242
- Vervoort M., Meulemeester D., Béhague J., and Kerner P. (2016). Evolution of Prdm Genes in Animals: Insights from Comparative Genomics. Mol. Biol. Evol. 33: 679-696. http://dx.doi.org/10.1093/molbev/msv260
- Gazave E.#, Béhague J.#, Laplane L., Guillou A., Préau L., Demilly A., Balavoine G., and Vervoort M. (2013). Posterior elongation in the annelid Platynereis dumerilii involves stem cells molecularly related to primordial germ cells. Dev. Biol 382, 246-267. # = co-first author. http://dx.doi.org/10.1016/j.ydbio.2013.07.013
- Demilly A., Gazave E., Steinmetz P., Marchand L., and Vervoort M. (2013). Involvement of the Wnt/b-catenin pathway in neurectoderm architecture in Platynereis dumerilii. Nat. Commun. 4:1915. http://dx.doi.org/10.1038/ncomms2915
- Kerner P., Degnan S.M., Marchand L., Degnan B.M., and Vervoort M. (2011). Evolution of RNA-binding proteins in animals: Insights from genome-wide analysis in the sponge Amphimedon queenslandica. Mol Biol Evol. 28, 2289-303. http://dx.doi.org/10.1093/molbev/msr046
- Dray N., Tessmar-Raible K., Le Gouar M., Vibert L., Christodoulou F., Snyman H., Béhague J., Vervoort M., Arendt D., and Balavoine G. (2010). The hedgehog pathway regulates segment formation in the annelid Platynereis. Science 329, 339-342. http://dx.doi.org/10.1126/science.1188913
Publications
Preprint
Revues
Chapitre de livre
- Elena Simionato. Evolution et diversification des protéines à basic Helix-Loop-Helix chez les métazoaires : apports pour la compréhension de l’évolution du système nerveux et de la neurogenèse. Directeur de thèse : Michel Vervoort. Ecole doctorale GGC (Université Paris 11). Thèse soutenue le 24 novembre 2008. Mention Très Honorable.
- Pierre Kerner. Etude de l’évolution du système nerveux chez les animaux : neurogenèse comparative et phylogénomique. Directeur de thèse : Michel Vervoort. Ecole doctorale GGC (Université Paris 11). Thèse soutenue le 13 février 2009. Mention Très Honorable.
- Adrien Demilly. Génomique fonctionnelle et neurogenèse chez l’annélide Platynereis dumerilii. Directeur de thèse : Michel Vervoort. Ecole doctorale GC2iD (Université Paris 5/Université Paris 7). Thèse soutenue le 21 décembre 2012, Mention très Honorable avec félicitations du jury.
- Loïc Bideau. Régénération postérieure chez l’annélide Platynereis dumerilii: origine et devenir des cellules du blastème de régénération. Directrice de thèse : Eve Gazave. Ecole doctorale BioSPC (Université de Paris). Thèse en cours (débutée le 1er septembre 2019).
- Aurore Vullien. Rôle des dérivés réactifs de l’oxygène (DRO) dans la régénération de structures complexes chez les annélides et les cnidaires. Directeurs de thèse : Eric Röttinger et Michel Vervoort. Thèse en cotutelle entre Université Paris Cité (Ecole doctorale BioSPC) et Université de Nice (Ecole Doctorale des Sciences de la Vie et de la Santé). Thèse en cours (débutée le 1er octobre 2020).
- Zoé Velasquillo. Unraveling regeneration success in animals through a single-cell approach. Directrice de thèse : Eve Gazave. Ecole doctorale BioSPC (Université Paris Cité). Thèse en cours (débutée le 1er octobre 2021).
- Stéphanie Bertrand et Hector Escriva (Observatoire océanologique de Banyuls, France)
- Jerome Hui (The Chinese University of Hong Kong, Hong Kong)
- Lucie Laplane (IHPST et IGR, France)
- Eric Röttinger (IRCAN Nice, France)
- Arnau Sebé-Pedros (CRG Barcelona, Spain)
- Morgane Thomas-Chollier (IBENS, France)
- The Paris Region Fellowship – 2021
- Programme Emergence de la recherche de l’Idex Université de Paris – 2020
- CNRS INSB – Diversity of biological mechanisms – 2020
- CNRS IEA (France / Spain Collaboration) – 2020
- ANR PRC – 2020
- Fondation ARC pour la recherche sur le Cancer – 2019
- Labex Who AmI ? – 2019
- Ligue Nationale Contre le Cancer – 2019
- Programme PROCORE (France/Hong Kong collaboration) – 2019
- McDonnell foundation – 2019
- EMBRC France – 2018
- CNRS MITI – 2018
- ANR PRCI (ANR/FWF) – 2017
- Labex Who AmI ? – 2016
- PICS CNRS – 2015
- Labex Who AmI ? – 2014
- Labex Who AmI ? – 2013
- ANR “Programme blanc” – 2012
- Institut Universitaire de France (IUF) – 2010
03/03/25 : Zoé Vélasquillo Ramirez reçois le Prix Jeune chercheur décerné par la Fondation des Treilles
6/01/25 Podcast france culture : L’homme de Denisova / Régénération chez les animaux / Deepfakes


