Trafic membranaire, ubiquitine et signalisation
Sébastien LEON
 Notre équipe cherche à déterminer les stratégies d’adaptation des cellules à des stress nutritionnels, tels que des carences ou une inhibition du métabolisme. Notre thématique se situe à l’intersection de la biologie cellulaire, de la signalisation cellulaire et du métabolisme, en utilisant notamment comme modèle d’étude la levure Saccharomyces cerevisiae.
Notre équipe cherche à déterminer les stratégies d’adaptation des cellules à des stress nutritionnels, tels que des carences ou une inhibition du métabolisme. Notre thématique se situe à l’intersection de la biologie cellulaire, de la signalisation cellulaire et du métabolisme, en utilisant notamment comme modèle d’étude la levure Saccharomyces cerevisiae.
Mots-clés : Endocytose, Membranes, Trafic, Transporteurs de nutriments, Métabolisme et Signalisation du glucose, AMPK / Snf1, Ubiquitine , Nedd4 / Rsp5, Arrestin-related proteins (ARTs, ARRDCs), Levure, Imagerie cellulaire, Protéomique, Métabolisme cancéreux, 2-désoxyglucose
+33 (0)1 57 27 80 57 Contact
Notre équipe étudie les stratégies d’adaptation des cellules à des stress nutritionnels, tels que des carences ou une inhibition du métabolisme. Nos travaux ont contribué à comprendre les mécanismes gouvernant l’endocytose de transporteurs par la présence ou l’absence de glucose. Ceci implique des protéines de la famille des arrestines, elles-mêmes régulées par des voies de signalisation en réponse à des changements nutritionnels. Plus récemment, nous avons initié une nouvelle thématique en étudiant les conséquences cellulaires d’un inhibiteur métabolique, le 2-désoxyglucose, et cherchons à comprendre les mécanismes de résistance à cette drogue.
1/ Régulation de l’endocytose par le statut nutritionnel de l’environnement
L’endocytose est un mécanisme cellulaire fondamental qui régule la présence et l’abondance de protéines (récepteurs, transporteurs) à la membrane plasmique.
L’endocytose de récepteurs est généralement induite par la présence du ligand correspondant (hormone, facteur de croissance) dans le milieu extracellulaire et contribue à limiter l’exposition des cellules au signal. Des défauts d’endocytose peuvent conduire à une signalisation aberrante et être à l’origine de pathologies dont certains cancers.
L’endocytose régule aussi la présence de transporteurs à la membrane plasmique en fonction de la composition nutritionnelle du milieu et de ses changements éventuels. Elle est donc une composante importante de l’adaptation des cellules à leur environnement.
L’endocytose de transporteurs est généralement déclenchée par leur ubiquitylation, qui agit comme un signal moléculaire.
Chez la levure, l’ubiquitylation des transporteurs est réalisée par Rsp5, une ubiquitine ligase de la famille Nedd4 qui comporte 9 membres chez l’homme. Cette étape fait aussi intervenir des protéines adaptatrices appelées ARTs (Arrestin-Related Trafficking adaptors). Chez l’homme, les protéines de type ARTs (appelées ARRDC) semblent fonctionner de façon similaire, et agissent comme suppresseurs de tumeurs.
Notre objectif est de comprendre comment les signaux extracellulaires contrôlent la fonction des arrestines, et par conséquent l’ubiquitylation des transporteurs et leur endocytose au cours de l’adaptation des cellules au milieu.
Notre organisme d’étude actuel est la levure Saccharomyces cerevisiae, qui a grandement contribué à la compréhension de mécanismes cellulaires conservés, dont l’endocytose.
Ce projet se situe dans le contexte de l’adaptation des cellules à la présence ou l’absence de glucose dans le milieu environnant. En effet, des changements de concentration de glucose du milieu conduisent à des modifications profondes de la composition en transporteurs de la membrane plasmique. Par exemple, une carence en glucose déclenche l’endocytose de la plupart des transporteurs de glucose (ex. Hxt3, Figure 1). A l’inverse, l’ajout de glucose à des cellules cultivées en présence de sources alternatives de carbone conduit à l’endocytose des transporteurs correspondants (ex. Jen1, Figure 1 et Film 1), afin de garantir que le glucose est la source de carbone dont l’utilisation sera privilégiée.
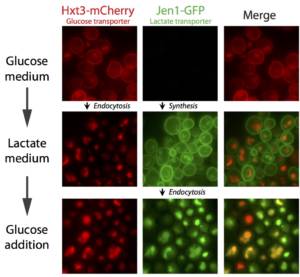
Figure 1. Le retrait de glucose ou son ajout dans le milieu de culture déclenchent l’endocytose de certains transporteurs. © Sébastien LEON, CNRS/IJM

Film 1. Endocytose du transporteur de lactate, Jen1, en réponse au glucose. Des levures sont perfusées en milieu lactate (10’) puis glucose (45’), grâce à un dispositif de microfluidique,
et observées séquentiellement (Plateforme d’imagerie ImagoSeine, IJM). Jen1-GFP quitte la membrane plasmique quelques minutes après l’ajout de glucose, pour atteindre les endosomes puis le compartiment lytique (lysosome, appelé vacuole chez la levure)
(ImagoSeine imaging facility, IJM). © Sébastien LEON, CNRS/IJM
Notre équipe a élucidé certains des mécanismes moléculaires impliqués dans ces régulations. En particulier, nous avons découvert que des voies de signalisation nutritionnelle régulent les modifications post-traductionnelles portées par les ARTs, ainsi que leur activité dans l’endocytose. La régulation des ARTs par la disponibilité en nutriments du milieu permet d’expliquer pourquoi l’endocytose des transporteurs est déclenchée uniquement dans certaines conditions physiologiques.
Nos travaux se sont récemment étendus aux effets d’un inhibiteur métabolique, le 2-désoxyglucose, sur l’endocytose.
2/ Toxicité d’un inhibiteur métabolique, le 2-deoxyglucose, et mécanismes de résistance associés
Le 2-désoxyglucose (2DG) est un analogue du glucose qui inhibe la croissance cellulaire en interférant avec l’utilisation du glucose dans de nombreux processus cellulaires, notamment la glycolyse et la N-glycosylation des protéines. Le 2DG a été considéré pour le traitement de tumeurs, suite aux observations que la majorité des cellules cancéreuses ont une consommation accrue de glucose. Un dérivé analogue du glucose, le 2-fluoro-2-désoxy-glucose, est d’ailleurs utilisé pour détecter certaines tumeurs (PET-scans).
Cependant, certaines cellules sont capables de contourner la toxicité du 2DG. Nous recherchons les mécanismes de résistance à cet inhibiteur grâce à des cribles génétiques chez la levure, basé sur la caractérisation de mutants devenus spontanément résistants au 2DG puis séquençage de leur génome. Nos travaux ont mis en avant que le 2DG déclenche l’activation de plusieurs voies de signalisation et l’induction d’enzymes détoxiquant un métabolite dérivé du 2DG. Une enzyme similaire a été identifiée chez l’homme.
D’autres stratégies de résistance sont actuellement à l’étude.
Cliquer ici pour consulter un résumé de nos résultats récents.
Membres
 Véronique ALBANESE, Chercheur, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Véronique ALBANESE, Chercheur, LEON LAB+33 (0)1 57 27 80 50, bureau 355B Alberto BALLIN, Doctorant, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Alberto BALLIN, Doctorant, LEON LAB+33 (0)1 57 27 80 50, bureau 355B Alexandre CORNILLE, Doctorant, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Alexandre CORNILLE, Doctorant, LEON LAB+33 (0)1 57 27 80 50, bureau 355B Samia MILED, ATER, LEON LAB+33 (0)1 57 27 80 57, bureau 355B
Samia MILED, ATER, LEON LAB+33 (0)1 57 27 80 57, bureau 355B Margot MOMEY, Stagiaire, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Margot MOMEY, Stagiaire, LEON LAB+33 (0)1 57 27 80 50, bureau 355B Matthieu SANIAL, Assistant ingénieur en biologie, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Matthieu SANIAL, Assistant ingénieur en biologie, LEON LAB+33 (0)1 57 27 80 50, bureau 355B Valerie SERRE, Enseignant-chercheur, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Valerie SERRE, Enseignant-chercheur, LEON LAB+33 (0)1 57 27 80 50, bureau 355B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Kahlhofer J, Leon S, Teis D, Schmidt O. The alpha-arrestin family of ubiquitin ligase adaptors links metabolism with selective endocytosis. Biology of the cell. 2021;113(4):183-219. Epub 2020/12/15. doi: 10.1111/boc.202000137. PubMed PMID: 33314196.
Le Boulch M, Brossard A, Le Dez G, Leon S, Rabut G. Sensitive detection of protein ubiquitylation using a protein fragment complementation assay. J Cell Sci. 2020;133(12):jcs.240093. doi: 10.1242/jcs.240093. PubMed PMID: 32409563.
Laussel C, Leon S. Cellular toxicity of the metabolic inhibitor 2-deoxyglucose and associated resistance mechanisms. Biochem Pharmacol. 2020;182:114213. doi: 10.1016/j.bcp.2020.114213. PubMed PMID: 32890467.
Ivashov V, Zimmer J, Schwabl S, Kahlhofer J, Weys S, Gstir R, Jakschitz T, Kremser L, Bonn GK, Lindner H, Huber LA, Leon S, Schmidt O, Teis D. Complementary alpha-arrestin-ubiquitin ligase complexes control nutrient transporter endocytosis in response to amino acids. eLife. 2020;9. doi: 10.7554/eLife.58246. PubMed PMID: 32744498.
Defenouillėre Q, Verraes A, Laussel C, Friedrich A, Schacherer J, Leon S. The induction of HAD-like phosphatases by multiple signaling pathways confers resistance to the metabolic inhibitor 2-deoxyglucose. Sci Signal. 2019;12(597):aaw8000. doi: 10.1126/scisignal.aaw8000. PubMed PMID: 31481524.
Hovsepian J, Albanese V, Becuwe M, Ivashov V, Teis D, Leon S. The yeast arrestin-related protein Bul1 is a novel actor of glucose-induced endocytosis. Mol Biol Cell. 2018;29(9):1012-20. doi: 10.1091/mbc.E17-07-0466. PubMed PMID: 29514933; PMCID: PMC5921569.
Hovsepian J, Defenouillere Q, Albanese V, Vachova L, Garcia C, Palkova Z, Leon S. Multilevel regulation of an alpha-arrestin by glucose depletion controls hexose transporter endocytosis. J Cell Biol. 2017;216(6):1811-31. Epub 2017/05/05. doi: 10.1083/jcb.201610094. PubMed PMID: 28468835; PMCID: PMC5461024.
Becuwe M, Leon S. Integrated control of transporter endocytosis and recycling by the arrestin-related protein Rod1 and the ubiquitin ligase Rsp5. eLife. 2014;3:03307. doi: 10.7554/eLife.03307. PubMed PMID: 25380227; PMCID: 4244573.
Becuwe M, Vieira N, Lara D, Gomes-Rezende J, Soares-Cunha C, Casal M, Haguenauer-Tsapis R, Vincent O, Paiva S, Léon S. A molecular switch on an arrestin-like protein relays glucose signaling to transporter endocytosis. J Cell Biol. 2012;196(2):247-59. Epub 2012/01/18. doi: 10.1083/jcb.201109113. PubMed PMID: 22249293.
Leon S, Erpapazoglou Z, Haguenauer-Tsapis R. Ear1p and Ssh4p are new adaptors of the ubiquitin ligase Rsp5p for cargo ubiquitylation and sorting at multivesicular bodies. Mol Biol Cell. 2008;19(6):2379-88. Epub 2008/03/28. doi: 10.1091/mbc.E08-01-0068. PubMed PMID: 18367543
Publications
Revues
- Alberto BALLIN (en cours, 2021-XXXX)
- Clotilde LAUSSEL (2021) “Mécanismes de résistance et de toxicité à l’inhibiteur métabolique, le 2-deoxyglucose »
- Junie HOVSEPIAN (2017) “L’arrestine Csr2/Art8 régule l’endocytose des transporteurs d’hexoses lors d’une carence en glucose chez Saccharomyces cerevisiae »
- Michel BECUWE (2014) “Rôle et régulation de l’Arrestine Rod1/Art4 dans le trafic des transporteurs chez la levure Saccharomyces cerevisiae”
- Alexandre SOULARD, Université Lyon I
- France Gwenaël RABUT, IGDR Rennes
- France Florian FROEHLICH, Univ. Osnabrück, Allemagne
- David TEIS, BioZentrum Innsbruck, Autriche
- Helle ULRICH, IMB Mainz, Allemagne
Nos travaux ont été financés par l’Agence Nationale pour la Recherche (ANR), la Fondation ARC pour la Recherche sur le Cancer, la Ligue contre le Cancer (Comité de Paris), la Fondation pour la Recherche Médicale (FRM), l’Université de Paris (IDEX), et le CNRS.


