Régulation de la dynamique du cytosquelette
GUILLAUME ROMET-LEMONNE & ANTOINE JEGOU
 Dans les cellules, l’assemblage des filaments d’actine est hautement régulé pour donner naissance à différents réseaux d’actine aux architectures bien contrôlées (cortex, lamellipode, filopode, …). Ces réseaux sont essentiels pour de nombreux processus (motilité, division, endocytose, …).
Dans les cellules, l’assemblage des filaments d’actine est hautement régulé pour donner naissance à différents réseaux d’actine aux architectures bien contrôlées (cortex, lamellipode, filopode, …). Ces réseaux sont essentiels pour de nombreux processus (motilité, division, endocytose, …).
Un grand nombre de protéines interagissent avec l’actine pour contrôler comment, où et quand les monomères d’actine s’assemblent en filaments. La compréhension de leurs activités biochimiques peut s’avérer très difficile à déchiffrer, en particulier lorsque ces activités dépendent du contexte cellulaire local et des contraintes mécaniques qui s’appliquent à chaque filament formant ces réseaux. Notre objectif est de comprendre les processus élémentaires de la mécanosensibilité de l’actine affectant la dynamique de l’actine et l’action des protéines régulatrices. Pour cela, notre équipe développe des approches expérimentales mélant microfluidique, micropatterning, et pinces optiques, afin de mener des expériences in vitro essentielles pour déchiffrer les réactions moléculaires individuelles qui régulent l’émergence des réseaux d’actine.
Mots-clés : cytosquelette, actine, biochimie, biophysique, mécanosensibilité, réseaux, mécanique
+33 (0)1 57 27 80 13 Contact Guillaume ROMET-LEMONNE & Contact Antoine JEGOU @romet-jegou-lab.bsky.social www.actindynamics.net
L’assemblage des monomères d’ATP-actine en filaments est à la base de la formation du cytosquelette d’actine dans les cellules. L’hydrolyse de l’ATP qui se produit au cours de ce processus s’accompagne d’un changement majeur de la conformation des sous-unités d’actine, donc du filament lui-même. Ces changements ont des conséquences profondes sur la régulation de la cinétique d’assemblage des filaments.
Dans les cellules, l’assemblage de l’actine est régulé par des centaines de protéines de liaison à l’actine (ABP pour Actin Binding Protein), qui peuvent agir ensemble, en synergie, ou sont en compétition. Ces ABPs peuvent se lier aux côtés, aux extrémités des filaments et/ou aux monomères et ont des effets variés. On les distingue généralement en fonction de leurs fonctions principales : nucléateurs, élongateurs, protéines qui favorisent le désassemblage des filaments, les stabilisent, ou encore les protéines qui relient les filaments entre eux ou à d’autres organelles.
Si les ABPs peuvent modifier l’état mécanique des filaments d’actine, des facteurs mécaniques externes peuvent à leur tour affecter l’activité des ABPs. Nous pensons que cette interaction mécano-chimique joue un rôle crucial dans l’assemblage du réseau d’actine dans les cellules.
Pour comprendre comment les ABPs et le contexte mécanique génèrent des réseaux de géométries, de dynamiques et de durées de vie variées, notre équipe concentre ses efforts sur l’observation et la manipulation in vitro de filaments d’actine uniques ou de petits réseaux reconstitués dans des conditions bien contrôlées. La microfluidique est un outil très puissant pour exposer les filaments à différentes solutions de protéines de manière séquentielle et pour exposer les filaments à diverses contraintes mécaniques, ouvrant ainsi de nouvelles voies pour déchiffrer la dynamique de l’assemblage des réseaux d’actine.
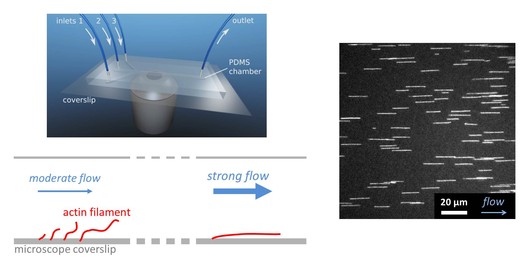
À droite, un croquis représente une chambre microfluidique standard avec 3 entrées positionnées au-dessus d’un objectif de microscope. Dans cette chambre, les filaments d’actine sont cultivés à partir d’amorces ancrées à la surface de la chambre expérimentale et s’alignent avec le flux. Des dizaines de filaments d’actine marqués par fluorescence peuvent être suivis en parallèle tout en étant exposés à diverses conditions biochimiques affectant leur dynamique.
Responsables
 Antoine JEGOU, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Antoine JEGOU, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B Guillaume ROMET-LEMONNE, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Guillaume ROMET-LEMONNE, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Membres
 Dina AL ABYAD, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LABbureau 390B
Dina AL ABYAD, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LABbureau 390B Camille BAGES, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Camille BAGES, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Jean-Baptiste BERTHELOT, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B
Jean-Baptiste BERTHELOT, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B Ingrid BILLAULT-CHAUMARTIN, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Ingrid BILLAULT-CHAUMARTIN, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B Luyan CAO, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Luyan CAO, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B Longcan CHENG, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LABbureau 390B
Longcan CHENG, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LABbureau 390B Thomas DOS SANTOS, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B
Thomas DOS SANTOS, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B Omar EL HAMOUI, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Omar EL HAMOUI, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Sara FAOUR, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB
Sara FAOUR, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB Bérengère GUICHARD, Biology engineer, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B
Bérengère GUICHARD, Biology engineer, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 30, bureau 381B Inaara KASSAMALY, PhD student, ROMET-LEMONNE/JEGOU LABbureau 390B
Inaara KASSAMALY, PhD student, ROMET-LEMONNE/JEGOU LABbureau 390B Wouter KOOLS, PhD student, ROMET-LEMONNE/JEGOU LABbureau 390B
Wouter KOOLS, PhD student, ROMET-LEMONNE/JEGOU LABbureau 390B Cécile LEDUC, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Cécile LEDUC, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Audrey MAGOARIEC, Intern, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Audrey MAGOARIEC, Intern, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Natalia NOJSZEWSKA, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B
Natalia NOJSZEWSKA, Biology engineer, ROMET-LEMONNE/JEGOU LABbureau 390B Lilian PATY, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Lilian PATY, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Adele SEBIRE, Intern, ROMET-LEMONNE/JEGOU LAB
Adele SEBIRE, Intern, ROMET-LEMONNE/JEGOU LAB Maritzaida VARELA SALGADO, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Maritzaida VARELA SALGADO, Postdoctoral researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Hugo WIOLAND, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Hugo WIOLAND, Researcher, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B Jiu XIAO, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Jiu XIAO, PhD student, ROMET-LEMONNE/JEGOU LAB+33 (0)1 57 27 80 56, bureau 385B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr
Wioland, H., Jégou, A., and Romet-Lemonne, G. (2022). Celebrating 20 years of live single-actin-filament studies with five golden rules. Proc. Natl. Acad. Sci. U. S. A. 119, e2109506119.
Wioland, H., Frémont, S., Guichard, B., Echard, A., Jégou, A., and Romet-Lemonne, G. (2021). Actin filament oxidation by MICAL1 suppresses protections from cofilin-induced disassembly. EMBO Rep. 22, e50965.
Cao, L., Yonis, A., Vaghela, M., Barriga, E.H., Chugh, P., Smith, M.B., Maufront, J., Lavoie, G., Méant, A., Ferber, E., et al. (2020). SPIN90 associates with mDia1 and the Arp2/3 complex to regulate cortical actin organization. Nat. Cell Biol. 1–12.
Hakala, M., Wioland, H., Tolonen, M., Kotila, T., Jegou, A., Romet-Lemonne, G., and Lappalainen, P. (2021). Twinfilin uncaps filament barbed ends to promote turnover of lamellipodial actin networks. Nat. Cell Biol. 23, 147–159.
Jégou, A., and Romet-Lemonne, G. (2020). Mechanically tuning actin filaments to modulate the action of actin-binding proteins. Curr. Opin. Cell Biol. 68, 72–80.
Suzuki, E.L., Chikireddy, J., Dmitrieff, S., Guichard, B., Romet-Lemonne, G., and Jégou, A. (2020). Geometrical Constraints Greatly Hinder Formin mDia1 Activity. Nano Lett. 20, 22–32.
Wioland, H., Jegou, A., and Romet-Lemonne, G. (2019). Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proc. Natl. Acad. Sci. U. S. A. 116, 2595–2602.
Cao, L., Kerleau, M., Suzuki, E.L., Wioland, H., Jouet, S., Guichard, B., Lenz, M., Romet-Lemonne, G., and Jegou, A. (2018). Modulation of formin processivity by profilin and mechanical tension. Elife 7, e34176.
Wioland, H., Guichard, B., Senju, Y., Myram, S., Lappalainen, P., Jégou, A., and Romet-Lemonne, G. (2017). ADF/Cofilin Accelerates Actin Dynamics by Severing Filaments and Promoting Their Depolymerization at Both Ends. Curr. Biol. 27, 1956–1967.e7.
Shekhar, S., Kerleau, M., Kühn, S., Pernier, J., Romet-Lemonne, G., Jégou, A., and Carlier, M.-F. (2015). Formin and capping protein together embrace the actin filament in a ménage à trois. Nat. Commun. 6, 8730.
Jégou, A., Carlier, M.-F., and Romet-Lemonne, G. (2013). Formin mDia1 senses and generates mechanical forces on actin filaments. Nat. Commun. 4, 1883.
Publications
Preprints
Revues
- Foad GHASEMI : 2020-2023.
- Léana LENGAGNE : 2021-2024
- Jiu XIAO : 2021-2024
A l’Institut Jacques Monod
The Nicolas Minc Lab
The Ladoux-Mège lab
En France
Arnaud Echard (Institut Pasteur, Paris, France)
Anne Houdusse (Institut Curie, Paris, France)
Aurélie Bertin (Institut Curie, Paris, France)
Terence Strick (IBENS, Paris, France)
Alexis Gautreau (Ecole Polytechnique, Palaiseau, France)
Olivia du Roure and Julien Heuvingh (ESPCI, Paris, France)
Martin Lenz (LPTMS, Orsay, France)
Christophe Le Clainche (I2BC, Gif/Yvette, France)
A l’étranger
Ewa Paluch (Univ. of Cambridge, UK)
Guillaume Charras (UCL, London, UK)
Philippe Roux ( Univ. of Montreal, Canada)
Pekka Lappalainen (Univ. of Helsinki, Finland)
Daryl Bosco (Univ. Massachusetts Medical School, USA)
Till Boecking (Univ. New South Wales, Sydney, Australia)
ANR, FRM, INSERM/ITMO, Labex WhoAmI?


