La méiose et ses mécanismes
Katja WASSMANN
Les projets de mon groupe visent à disséquer les mécanismes moléculaires sous-jacents aux deux divisions méiotiques en mettant l’accent sur les ovocytes, pour comprendre comment les erreurs se produisent. La question centrale que nous étudions porte sur la manière dont les événements spécifiques à la méiose I sont exécutés uniquement dans la méiose I, et ceux de la méiose II uniquement dans la méiose II.
La reproduction sexuée nécessite la génération de gamètes haploïdes à travers deux divisions méiotiques, appelées méiose I et II. Chez les mammifères et en particulier chez l’humain, la gamétogenèse féminine est très sujette aux erreurs, conduisant à la génération d’ovocytes contenant le mauvais contenu chromosomique.
Mots-clés : Méiose, Ovocytes, Cohésine, Phosphoprotéome, Cycle cellulaire, Aneuploïdie
+33 (0)1 57 27 81 48 contact @meiosis-mom.bsky.social https://www.researchgate.net/profile/Katja-Wassmann
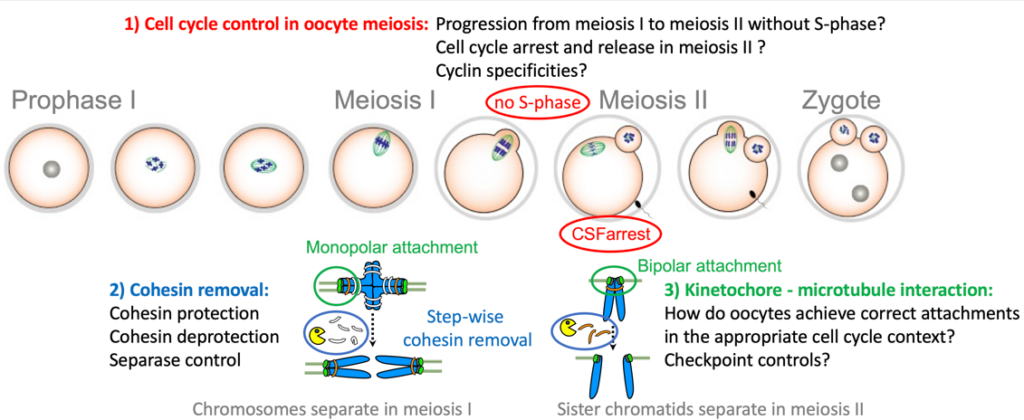
Pendant la méiose, les événements clés doivent se produire dans le bon ordre et au bon moment, afin de ne pas compromettre la génération de gamètes sains. Dans nos projets, nous tentons d’élucider les mécanismes de régulation d’événements spécifiques de la méiose avec un accent particulier sur les ovocytes. Le but est de mieux comprendre comment ces événements sont mis en place au bon stade du développement, c’est à dire lors de la méiose I ou II. Spécificités des divisions méiotiques (méiose I et II) :
- Les chromosomes homologues (chacun composé de deux chromatides sœurs) sont appariés et séparés lors de la méiose I, et les chromatides sœurs lors de la méiose II
- Les kinétochores (les sites de fixation du fuseau bipolaire) des deux paires de chromatides sœurs sont co-orientés vers le même pôle lors de la méiose I, et biorientés vers les pôles opposés lors de la méiose II (appelés orientation ou attachement mono- et bipolaire, respectivement).
- Le complexe cohésine, qui maintient ensemble les chromatides sœurs, est retiré par étapes, en premier des bras chromosomiques lors de la méiose I puis des régions centromerique lors de la méiose II.
- La transition de la méiose I à la méiose II se produit sans phase S intermédiaire
Une spécificité supplémentaire des ovocytes de vertébrés est la nécessité de mettre en place deux arrêts du cycle cellulaire : un avant l’entrée en méiose I, en prophase I, qui dure des décennies chez l’homme ; un deuxième arrêt en métaphase de méiose II, appelé CSF-arrest, pour attendre la fécondation.
La question centrale de nos projets est la suivante :
Comment se déroulent les deux divisions méiotiques successives sans fusionner les événements spécifiques de la méiose I et de la méiose II ?
Nos questions scientifiques :
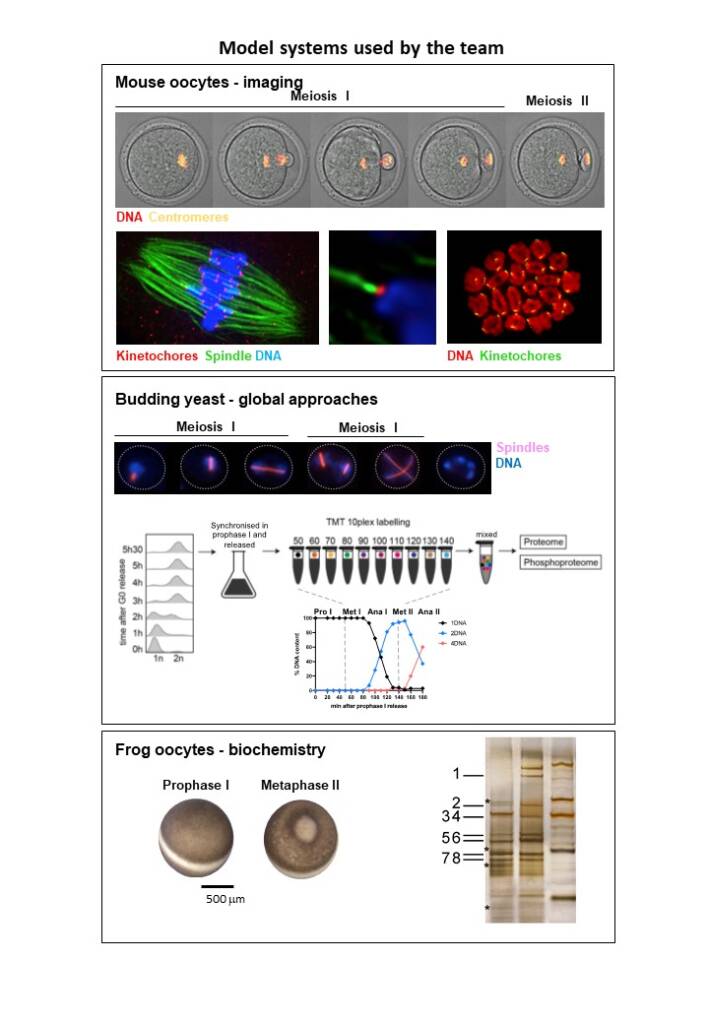
Modèles d’étude que nous utilisons en laboratoire :
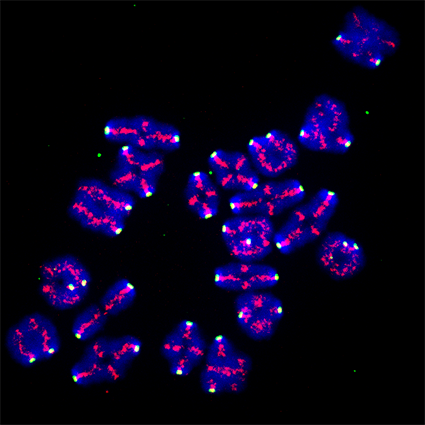
 La figure 1 montre la progression meiotique chez la levure, la souris et le xenope.
La figure 1 montre la progression meiotique chez la levure, la souris et le xenope.
Projets 1 : Contrôle du cycle cellulaire méiotique, spécificités et niveaux de Cdk-Cycline
Nous pensons qu’une vision globale de la phosphorylation et de la déphosphorylation des substrats des kinases mitotiques est essentielle pour comprendre comment la transition de la méiose I à la méiose II est régulée. Notre but est de disséquer les principes communs régissant les divisions méiotiques., Afin de mieux comprendre cette transition spéciale du cycle cellulaire dans un système modèle simple, nous utilisons actuellement la levure bourgeonnante comme modèle d’étude afin de répondre à cette question. Avec un génome de petite taille, la levure permet de simplifier la complexité d’analyse à laquelle on peut s’attendre dans les ovocytes.De plus, en utilisant des ovocytes de la grenouille et de la souris, nous étudions les spécificités des cyclines et les différents niveaux d’activité de Cdk pour la mise en place d’événements du cycle cellulaire spécifiques à la méiose. Nous avons découvert qu’au moins deux cyclines de phase M – les cyclines A2 et B3 – occupent des rôles spécifiques qui ne sont pas redondants avec d’autres cyclines. Les deux cyclines ont des fonctions spécifiques à la méiose I et à la méiose II. Nos projets visent à identifier des substrats spécifiques de ces cyclines et les mécanismes moléculaires sous-jacents dans la méiose.
Projet 2 : Élimination par étapes de la cohésine dans les ovocytes de mammifères
L’élimination par étapes de la cohésine est due au fait que la sous-unité de cohésine Rec8 est protégée du clivage par la protéase Separase au niveau de la région du centromère lors de la méiose I. Par contre en méiose II, Rec8 centromerique n’est plus protégée et est clivée permettant la ségrégation des chromatides sœurs. La protection est due au recrutement de Sgo2 qui recrute la phosphatase PP2A au centromère pour y maintenir Rec8 dans un état déphosphorylé. Cependant, plusieurs questions demeurent ; notamment comment l’activité de la séparase est contrôlée pour être inhibée et activée deux fois, et comment les protéines impliquées dans la protection protègent la cohésine lors de la méiose I (mais pas dans la méiose II) et ceci uniquement dans la région du centromère.
Projet 3 : Attachements des kinetochores et analyse des points de contrôle dans les ovocytes de mammifères
Un autre acteur du cycle cellulaire, qui est agi différemment en méiose I et II, sont les points de contrôle. Nous voulons comprendre comment les points de contrôle peuvent reconnaître les bons attachements dans leur propre contexte, c’est-à-dire des attachements monopolaires pour séparer les chromosomes lors de la méiose I et des attachements bipolaires pour séparer les chromatides sœurs lors de la meiose II. De plus, nous examinons si les deux kinétochores sont fonctionnels dans la méiose I lorsqu’ils sont mono-orientés et fusionnés
Membres
 Eulalie BUFFIN, Enseignant-chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B
Eulalie BUFFIN, Enseignant-chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B Esther CHANTY, Ingénieure d études, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Esther CHANTY, Ingénieure d études, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Damien CLADIERE, Ingénieur en biologie, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Damien CLADIERE, Ingénieur en biologie, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Aude-Isabelle DUPRE, Chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B
Aude-Isabelle DUPRE, Chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B Safia EL JAILANI, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Safia EL JAILANI, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Cindy GENOUD, Ingénieure d études, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Cindy GENOUD, Ingénieure d études, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Emmanuelle MARJAULT, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Emmanuelle MARJAULT, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Irem POLAT, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B
Irem POLAT, Doctorante, WASSMANN LAB+33 (0)1 57 27 80 66, bureau 322B Aymane SADOUNI, Ingénieur d’études, WASSMANN LAB
Aymane SADOUNI, Ingénieur d’études, WASSMANN LAB Sandra TOUATI, Chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B
Sandra TOUATI, Chercheur, WASSMANN LAB+33 (0)1 57 27 80 35, bureau 322B
Pour contacter un membre de l’équipe par mail : prenom.nom@ijm.fr

Celebic D, Polat I, Legros V, Chevreux G, Wassmann K, Touati SA.
Qualitative rather than quantitative phosphoregulation shapes the end of meiosis I in budding yeast.
EMBO J. 2024 Apr;43(7):1325-1350.
Bouftas N.*, Schneider L.*, Halder M., Demmig R., Baack M., Cladière D., Walter M., Al Abdallah H., Kleinhempel C., Messaritaki R., Müller J., Passarelli F., Wehrle P., Heim A., Wassmann K.#+ and Mayer T.U.#
Cyclin-B3 prevents Emi2/Xerp1 from setting up precocious CSF-arrest in oocyte meiosis I,
Dev. Cell (2022) 57, 2305-2320
(*co first-authors, #co-corresponding authors, +lead author)
Nikalayevich E., El Jailani S., Cladière D., Gryaznova Y., Fosse C., Touati S.A., Buffin E., and Wassmann K.
Aurora B/C-dependent phosphorylation promotes Rec8 cleavage in mammalian oocytes
Current Biology (2022) doi: 10.1016/j.cub.2022.03.041, in press
Gryaznova Y., Keating L.*, Touati S.A.*, Caldière D., El Yakoubi W., Buffin E., and Wassmann K.
Kinetochore individualization in meiosis I is required for centromeric cohesin removal in meiosis II,
EMBO J. (2021) 40, e106797 (*co second-authors)
Mehmet E. Karasu*, Bouftas N.*, Keeney S., and Wassmann K.
Cyclin B3 promotes anaphase I onset in oocyte meiosis,
J Cell Biol. (2019) 218, 1265-1281 (*co first-authors)
Vallot A., Leontiou I., El Yakoubi W., Cladière D., Bolte S., Buffin E.*, and Wassmann K.*+
Tension-induced error correction, and not kinetochore attachment status activates the SAC in an Aurora-B/C-dependent manner in oocytes,
Current Biology (2018) 28, 130-139 (*co-corresponding authors, + lead author )
El Yakoubi W., Buffin E., Cladière D, Gryaznova Y., Berenguer I., Touati S.A., Gómez R. , Suja J.A.,van Deursen J.M., and Wassmann, K.
Mps1 kinase-dependent Sgo2 centromere localization mediates cohesin protection in mouse oocyte meiosis I,
Nature Communications (2017) DOI: 10.1038/s41467-017-00774-3
Touati S., Buffin E., Cladière D., Rachez C., Hached K., van Deursen J.M., and Wassmann K.
Mouse oocytes depend on BubR1 for proper chromosome segregation but not prophase I arrest,
Nature Communications (2015) DOI: 10.1038/ncomms7946
Chambon J.P., Touati S., Berneau S., Cladière D., Hebras C., Groeme R., McDougall A., and Wassmann K.
The PP2A inhibitor I2PP2A is essential for sister chromatid segregation in meiosis II,
Current Biology (2013) 23, 485-490
Touati S., Cladière D, Lister L.M., Leontiou I., Chambon J.P., Rattani A., Böttger F., Stemmann O., Nasmyth K., Herbert M., and Wassmann K.
Cyclin A2 is required for sister chromatid segregation, but not Separase control, in mouse oocyte meiosis,
Cell Reports (2012) 29, 1077-1087
Kudo N.R.*, Wassmann K.*, Anger M., Schuh M., Wirth G.K., Xu H., Helmhart W., Kudo H., Mckay M., Maro B., Ellenberg J., de Boer P., and Nasmyth K.
Resolution of Chiasmata in Oocytes Requires Separase-Mediated Proteolysis,
Cell (2006) 126, 135-146 (*co first-authors)
Wassmann K.*, Niault T., and Maro B.
Metaphase I Arrest Upon Activation of the Mad2-Dependent Spindle Checkpoint in Mouse Oocytes
Curr. Biol. (2003) 13, 1596-1608 (*corresponding author)
Publications
Revues
Chapitre de livre
Thèse soutenues :
- Dunja Čelebić: 2020 – 2023
- Antoine Langeoire-Cassalta: 2019 – 2023
- Leonor Keating: 2017 – 2021
- Nora Bouftas: 2015 – 2019
- Antoine Vallot: 2014 – 2017
- Sandra Touati: 2011 – 2014
- Khaled Hached: 2006 – 2010
Thèse en cours :
- Safia El Jailani: 2021 –
- Irem Polat: 2023 –
- Emmanuelle Marjault: 2024 –
- Thomas Mayer, University of Konstanz, Germany
- Evelyn Houliston, Laboratoire Océanologique de Villefranche-sur-Mer, France
- ANR JCJC 2022 – 2025
- ANR PRC 2023 –
- ANR PRC 2024 –
- ARC 2023 – 2024
04/07/2023 – Katja Wassmann, élection en tant que membre de la communauté EMBO

